- Le
matériel :
- Fermenteur
2L B Braun contenant 1,5 L de milieu LB
- composition
du milieu LB pour 1L :
Tryptone
Extrait de levure
NaCl |
|
10g
5g
10g |
|
- Inoculum :
culture d'une nuit d'Escherichia coli en milieu LB ensemencement
à raison de 5% (v/v)
- Glucose, lactose
- eau distillée
- fiole jaugée,
seringue, filtre
- La
méthode :
- Introduire
stérilement par filtration dans le fermenteur aux concentrations
finales :
- une solution
de glucose à 0,2 g/L
- et une
solution de lactose à 2 g/L
- Paramètres
de la fermentation :
- Température
: 37°C
- Agitation
: 300 rpm
- Aération
: 2 vvm
- Eventuelle
régulation du pH à 7
- Effectuer
un suivi toutes les 10 minutes
- du trouble
à 600 nm
- du pH
si ce paramètre n'est pas régulé ou des
volumes d'acide et de base versés dans le cas contraire
- de la
concentration en glucose restant par méthode enzymatique
après centrifugation du prélèvement
- de la
présence ou non de glucose et de lactose par chromtographie
sur couche mince.
- Les
résultats :
- Etude
qualitative des oses :
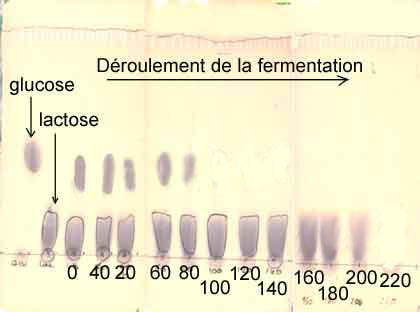
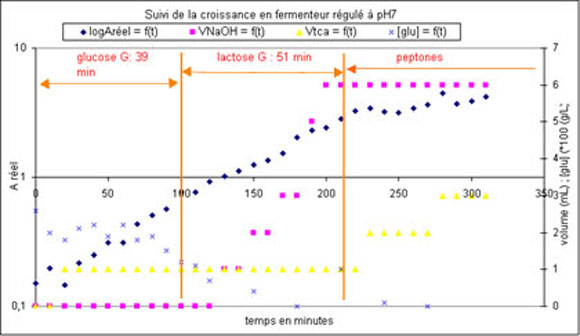
- Suivi
quantitatif des paramètres de la croissance :
|